医院伦理委员会
会议审查标准操作规程
1. 目的
为使伦理委员会审查会议的会前准备、会议工作、会后工作有章可循,特制定本规程,以从程序上保证伦理委员会审查会议的管理工作的质量。
2. 范围
本SOP适用于伦理委员会对审查会议的服务性管理工作,主任委员主持审查会议的程序性工作。
3. 职责
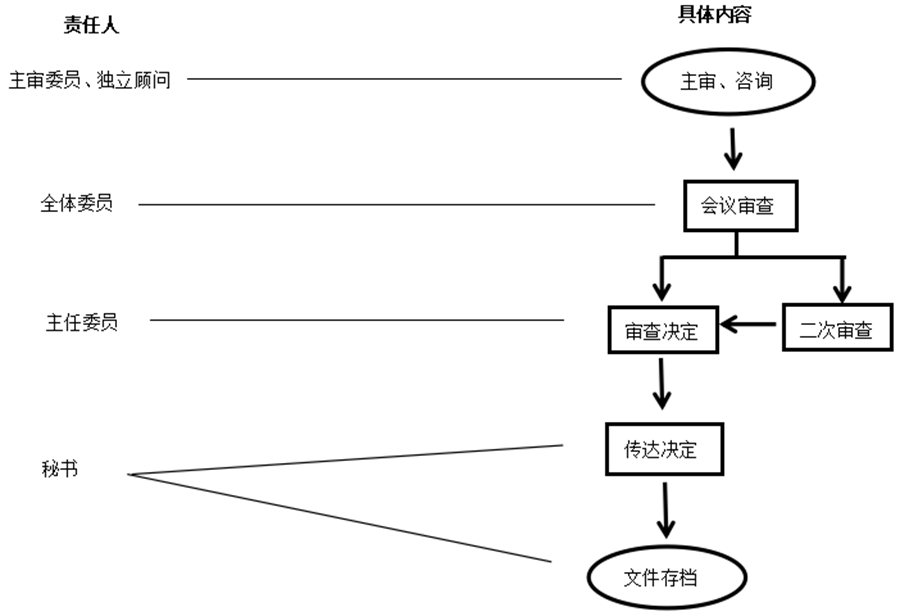
3.1 伦理委员会秘书
3.1.1 会前安排会议日程,通知委员∕独立顾问和项目负责人(或委托人),准备会议文件和会场。
3.1.2 会议期间负责会议签到,核对到会人数,向会议报告快速审查项目,报告审查意见的投票结果,做好委员审查发言的会议记录。
3.1.3 会后整理会场,整理形成会议记录,起草决定文件,管理审查文件。
3.2 主审委员
3.2.1 会前审查主审项目的送审文件,填写主审工作表。
3.2.2 会议审查作为主要发言者,提问和发表审查意见。
3.3 独立顾问(如有)
3.3.1 会前审查咨询项目的送审文件,填写咨询工作表。
3.3.2 受邀参加审查会议,陈述意见。
3.4 委员
3.4.1 参加审查会议,审查每一项目,提问和发表审查意见。
3.4.2 以投票方式做出审查决定。
3.5 副主任委员
3.5.1经主任委员授权后可审签会议记录;
3.5.2经主任委员授权后可审核、批准、签发审查意见和决定文件。
3.5 主任委员
3.5.1主持审查会议。
3.5.2审签会议记录。
3.5.3审核、批准、签发审查决定文件。
4.流程图
见附件1。
5. 审核程序
5.1 主审∕咨询
5.1.1 选择2名以上主审委员(优先选择医药专业背景委员主审研究方案;优先选择非医药专业背景委员主审知情同意书;复审、跟踪审查优先选择该项目的初审委员),并为主审委员准备整套送审文件及相应的审查工作表。
5.1.2 一般选择1-2名独立顾问(主要基于需要咨询的审查问题与侯选人专业领域与社会文件背景相符的考虑),并为其准备相关的送审文件及咨询工作表。
5.1.3 主审委员:在会议前审查送审材料;根据方案的研究设计类型和伦理审查类别的审查要素与审查要点,审查每一项研究,并填写审查工作表。
5.1.4 独立顾问:在会议前审查送审文件;根据需要咨询的问题进行审阅,提供咨询意见,并填写咨询工作表。
5.2 会议审查
5.2.1 委员人数及组成
5.2.1.1到会委员超过伦理全体委员会组成人员人数的2/3。
5.2.1.2 到会委员应包括医药专业、非医药专业、独立于研究设施机构之外的委员,以及不同性别的委员。
5.2.2 会议报告项目的审查
5.2.2.1秘书报告近期伦理的工作, 本次会议审查项目基本情况。
5.2.3 会议审查项目的审查
5.2.3.1 听取项目负责人(或委托人)报告
5.2.3.2 提问并听取回答
5.2.3.3 根据方案的研究设计类型和伦理审查类别的审查要素与审查要点,审查每一项研究。
5.3 审查决定
5.3.1 决定的程序
5.3.1.1 确定送审文件齐全,到场委员符合法定人数。
5.3.1.2 项目负责人(或委托人)、独立顾问(如有)、与研究项目存在利益冲突的委员离场。
5.3.1.3 到会委员有充分的时间按审查程序和审查要点进行审查和充分讨论,尽可能达成一致意见。
5.3.1.4 以投票方式做出决定:没有参加该项目会议讨论或与研究项目存在利益冲突的委员不能投票。
5.3.1.5 以超过全体伦理委员会委员半数票的意见作为审查决定。
5.3.1.6 秘书汇总投票单,填写会议审查决定表。
5.3.1.7 主主任委员或副主任委员(经主任委员授权后)审核、批准、签发审查决定文件。
①是否批准研究项目(同意,作必要修改后同意,不同意,终止或暂停已批准的研究)。②根据研究的风险程度,确定跟踪审查的频率,最长不超过12个月。
③确定伦理审查批件的有效期:初始审查以及(初始审查后的)复审,审查决定为“同意”,批件的有效期可以由伦理委员会主任决定采用以下几种方式确定:根据临床研究预期的周期;与跟踪审查频率相同。
④延长批件有效期:如果批件有效期到期,研究进展报告提出“延长批件有效期”申请,年度/定期跟踪审查的决定为“同意”,批件的有效期可以由伦理委员会主任根据上个周期内项目开展情况决定延长批件的时限。
5.4 传达决定
5.4.1 制作:
5.4.1.1
制作决定文件(一式三份):文件份数参照项目负责人(或委托人)、研究中心数确定。一般按项目委托方1份、研究单位2份;或根据申办者的要求;
5.4.1.2 制作会议签到表副本:初始审查、修改案审查以及(初始审查、修改案审查之后的)复审的决定,如果采用会议审查方式,需附“会议签到表”副本;
5.4.2 盖章
决定文件加盖伦理委员会章。
5.4.3 传达
5.4.3.1 决定文件送达(本院)项目负责人(或委托人):通知申办方领取决定文件;
5.4.3.3 传达时限:①审查决定后5个工作日内完成决定的传达。②紧急会议审查决定于审查决定后及时传达,最长不超过3个工作日。
5.5 文件存档
5.5.1审查过程中形成、积累、保存的文件,按审查阶段及时归档,建立/更新项目档案目录。
5.5.2会议审查的项目存档文件:项目送审文件,会议审查工作表,会议签到表,会议投票单,伦理审查费发放表,会议记录本,会议审查决定文件。
5.5.3快速审查项目中存档文件:项目送审文件,会议审查工作表,主审审查工作表,伦理审查决定文件。
参考依据:
《世界医学大会赫尔辛基宣言》
ICH指导原则
《涉及人的生命科学和医学研究伦理审查办法》(2023年)
《伦理委员会制度与操作规程》(2021年)
《药物临床试验伦理审查工作指导原则》(2010年)
《药物临床试验质量管理规范》(2020年版)》
《医疗器械临床试验质量管理规范》(2022年)
附件1: