医院伦理委员会
严重不良事件审查标准操作规程
1. 目的
使伦理委员会严重不良事件审查的受理、处理、审查、传达决定、文件存档等工作有章可循,从程序上保证严重不良事件审查工作的质量。
2. 范围
适用于伦理委员会对发生在本中心和其它中心发生的严重不良事件进行审查。
3. 职责
3.1 伦理委员会秘书
3.1.1 受理送审材料。
3.1.2 处理送审材料。
3.1.3 为委员审查工作提供服务。
3.1.4 传达决定。
3.1.5 文件存档。
3.2 主审委员
3.2.1 会前审查主审项目的送审文件,填写主审工作表。
3.2.2 如果为会议审查的方式,则会议审查作为主要发言者,提问和发表审查意见。
3.3 独立顾问
3.3.1 如有独立顾问,则填写咨询工作表,审查咨询项目的送审文件。
3.3.2如果为会议审查的方式,则受邀参加审查会议,陈述意见。
3.4 委员
3.4.1如果为会议审查的方式,则参加审查会议,审查每一项目,提问和发表审查意见。
3.4.2如果为会议审查的方式,以投票方式做出审查决定。
3.5 副主任委员
3.5.1如果为会议审查的方式,则经主任委员授权后可审签会议记录;
3.5.2经主任委员授权后可审核、批准、签发审查意见和决定文件。
3.5 主任委员
3.5.1主持审查会议。
3.5.2审签会议记录。
3.5.3审核、批准、签发审查决定文件。
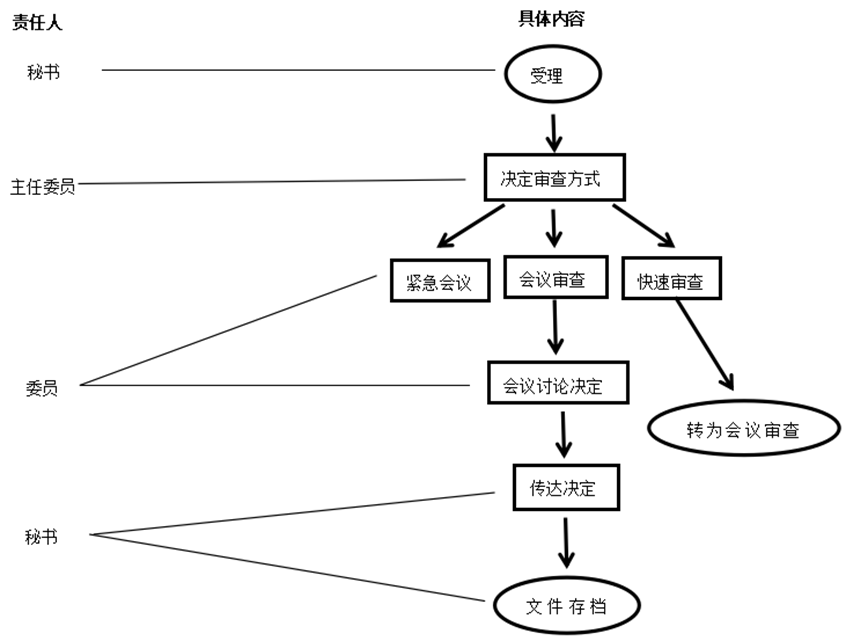
4. 流程图
见附件1。
5 审核程序
5.1 受理
5.1.1 伦理秘书接收送审文件时,对其完整性(其他中心发生的非预期的药物严重不良反应,送审文件需包括该中心的伦理审查意见)和规范性(严重不良事件报告填写正确、完整,项目负责人(或委托人)签名并注明日期)进行形式审查。
5.1.2 如审核资料符合伦理要求,秘书5个工作日内出具受理通知,进入处理程序。
5.1.3 如审核资料不符合要求,需修改、补充的,秘书5个工作日内出具修改、补充并通知给项目负责人(或委托人)。
5.1.4 修改、补充后受理以及送审文件管理,按照研究项目的受理执行。
5.2 处理
5.2.1 决定审查方式
5.2.1.1 以下情况采用会议审查:①本中心发生的与研究干预肯定有关的、非预期严重不良事件;②本中心发生的与研究干预不确定的、非预期严重不良事件,且需要重新评估研究的风险与受益;③其它中心发生的严重不良事件,且需要重新评估研究的风险与受益。
5.2.1.2 研究过程中出现重大或严重问题,危及受试者安全时,采用紧急会议审查。
5.2.1.3 以下情况采用快速审查:①本中心发生的与研究干预无关的严重不良事件;②本中心发生的预期严重不良事件。
5.2.1.4 以下情况采用备案:①其它中心发生的严重不良事件,对预期的研究风险与受益没有产生显著影响。
5.2.1.5 以下情况转为会议审查:①快审主审意见有“作必要修订后重审”, “终止或暂停已批准的研究”,“提交会议审查”; ②两名主审委员的审查意见不一致。
5.2.2 审查的准备
5.2.2.1 主审委员的选择:选择2名以上主审委员;优先选择原主审委员,和/或专门负责SAE审查的委员。
5.2.2.2 准备审查文件:送审文件的完整性和规范性符合要求后,伦理秘书为主审委员准备主审项目的整套送审文件,必要时,提供查阅当前使用版本的方案和知情同意书的便利条件。
5.2.2.3 会议审查安排、会议报告的安排,参照研究项目的处理执行。
5.3 审查
5.3.1 主审委员在5个工作日内完成对送审文件的以下审查:
• 不良事件程度的判断:□轻度,□中度,□重度
• 严重不良事件与试验用药关系:□肯定有关,□可能有关,□可能无关,□肯定无关,□无法判断
• 严重不良事件是否预期的判断:□预期,□非预期,□不适用
• 严重不良事件是否影响研究预期风险与受益的判断:□是,□否,□不适用
• 受损伤的受试者的医疗保护措施是否合理:□是,□否
• 其他受试者的医疗保护措施是否合理:□是,□否
• 是否需要修改方案或知情同意书:□是,□否
5.3.2 主审委员填写SAE主审审查工作表。
5.3.3 伦理秘书汇总主审委员意见,提交主任委员或其授权的伦理委员审核。
5.3.4 如为会议审查的方式,则主任委员副主任委员(经主任委员授权后)对委员意见进行审核。
5.3.5 主任委员或副主任委员(经主任委员授权后)批准、签发决定文件。
5.3.5.1是否同意研究继续进行(同意研究继续进行,作必要修改后同意研究继续进行,作必要修改后进行重新审核,终止或暂停已批准的研究)。
5.3.5.2根据研究风险有无变化等情况,决定是否调整跟踪审查的频率。
5.3.5.3快速审查是否更改审查方式(提交会议审查),如需会议审查,参照会议审查的SOP进行审查后签发审核决定。
5.4 传达决定
5.4.1 制作:
5.4.1.1
制作决定文件(一式三份):文件份数参照项目负责人(或委托人)、研究中心数确定。一般按项目委托方1份、研究单位2份;或根据申办者的要求;
5.4.1.2 制作会议签到表副本:如果采用会议审查方式,需附“会议签到表”副本;
5.4.2 盖章
决定文件加盖伦理委员会章。
5.4.3 传达
5.4.3.1 决定文件送达(本院)项目负责人(或委托人):通知申办方领取决定文件;
5.4.3.2 传达时限:在审查决定后5个工作日内完成决定的传达,紧急会议审查决定于审查后及时传达,最长不超过3个工作日。
5.5 文件存档
5.5.1 审查过程中形成、积累、保存的文件,按审查阶段及时归档,建立/更新项目档案目录。
5.5.2 会议审查的项目存档文件:项目送审文件,审查工作表,会议签到表,会议投票单,伦理审查费发放表,会议记录本,伦理审查决定文J件。
5.5.3快速审查项目存档文件:项目送审文件,严重不良事件主审审查工作表,伦理审查决定文件。
参考依据:
《世界医学大会赫尔辛基宣言》
ICH指导原则
《涉及人的生命科学和医学研究伦理审查办法》(2023年)
《伦理委员会制度与操作规程》(2021年)
《药物临床试验伦理审查工作指导原则》(2010年)
《药物临床试验质量管理规范》(2020年版)》
《医疗器械临床试验质量管理规范》(2022年)
附件1: